Diamine
| Technisch wichtige Diamine (Auswahl) |
Allgemeine Struktur eines Diamins. Die primären Amino-Gruppen (NH2) sind blau markiert, R ist ein zweibindiger organischer Rest (z. B. eine para-Phenylengruppe). |
Hexamethylen-1,6-diamin |
 2,4-Diaminotoluol |
 Diphenylmethan-4,4'-diamin |
 Isophorondiamin |
Diamine sind eine Stoffgruppe in der organischen Chemie. Es sind aliphatische oder aromatische Verbindungen, die zwei Aminogruppen (NH2) enthalten.[1] Geminale Diamine, bei denen sich die beiden Aminogruppen am selben Kohlenstoffatom befinden, werden als Aminale bezeichnet.
Eigenschaften
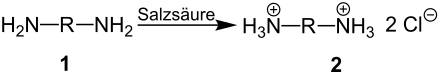
[Bearbeiten | Quelltext bearbeiten]Im Gegensatz zu aromatischen Diaminen – wie z. B. Phenylendiamin – sind viele aliphatische Diamine in Wasser löslich. Die Lösungen reagieren alkalisch. Mit Säuren bilden Diamine Salze. So entstehen z. B. durch Umsetzung des Diamins 1 (R = zweibindiger organischer Rest, z. B. 1,2-Ethylen oder Phenylen) mit Salzsäure Dihydrochloride 2, die meist gut wasserlöslich sind:[1]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Diamine werden verwendet als
- Stabilisatoren von Melaminharzen,
- Zusätze zu Epoxidharzen,
- zur Synthese von Farbstoffen,
- zur Synthese von Arzneistoffen,
- zur Synthese von Diisocyanaten,
- Ausgangsstoff für Polyamide,
- Liganden in der Komplexchemie etc.
Diisocyanate
[Bearbeiten | Quelltext bearbeiten]Diisocyanate werden aus Diaminen durch Umsetzung mit Phosgen (COCl2) hergestellt:[2]
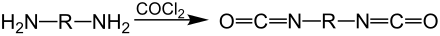
Der Reaktionsverlauf entspricht der Umsetzung von primären Aminen mit Phosgen.[3] Diisocyanate sind technisch wichtige Rohstoffe für die Herstellung von Polyurethanen (z. B. „Bauschaum“).
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Otto-Albrecht Neumüller (Herausgeber): Römpps Chemie Lexikon, 8. Auflage, Frank’sche Verlagshandlung, Stuttgart 1983, ISBN 3-440-04513-7, S. 926.
- ↑ Otto-Albrecht Neumüller (Herausgeber): Römpps Chemie Lexikon, 8. Auflage, Frank’sche Verlagshandlung, Stuttgart 1983, ISBN 3-440-04513-7, S. 961.
- ↑ Joachim Buddrus, Bernd Schmidt: Grundlagen der Organischen Chemie, 5. Auflage, de Gruyter Verlag, Berlin 2015, ISBN 978-3-11-030559-3, S. 682–683.